
Способы получения оксидов, оснований, кислот и солей. Урок №2 презентация онлайн
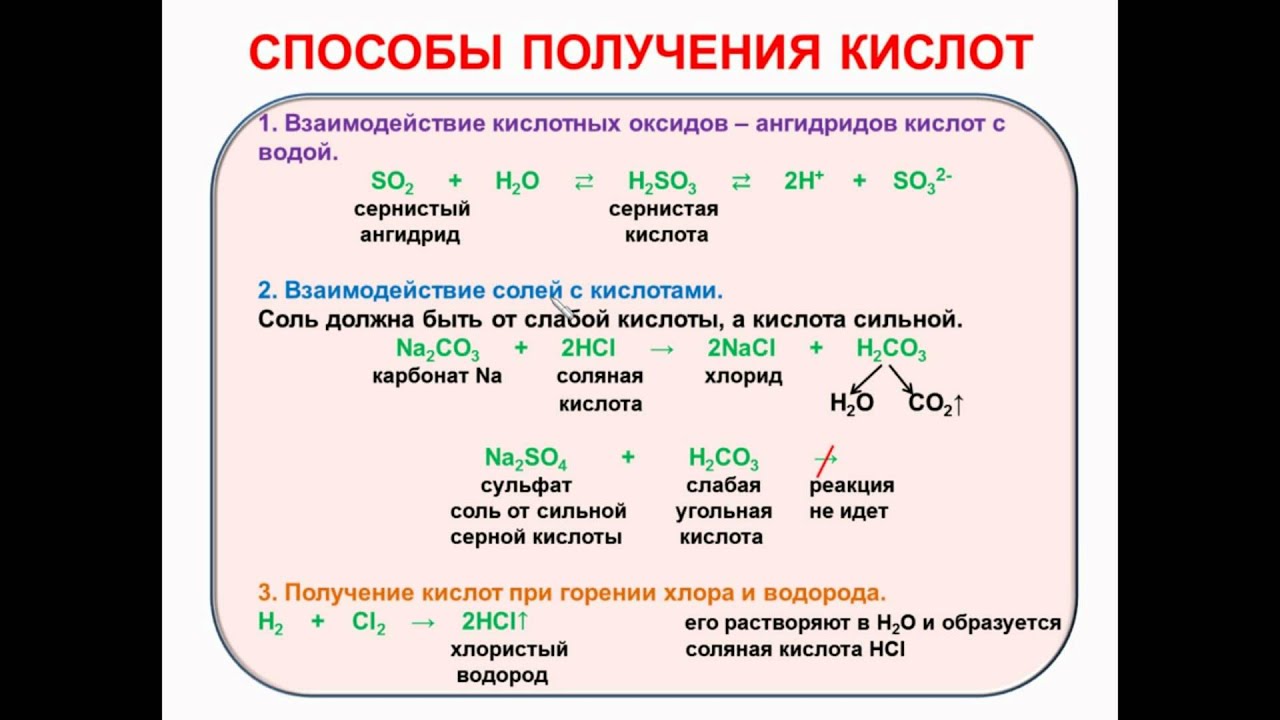
Получение кислот . 1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая.

Способы получения оксидов, оснований, кислот и солей. Урок №2 презентация онлайн
В этой лекции мы рассмотрим определение кислот, их химические свойства, способы получения и примеры некоторых кислот.

Способы получения кислот YouTube
В уроке 36 «Получение и применение кислот» из курса «Химия для чайников» изучим все возможные способы получения кислот в лабораторных условиях, а также узнаем о широком спектре применения.

Карбоновые кислоты номенклатура и классификация, основные свойства, получение и применение
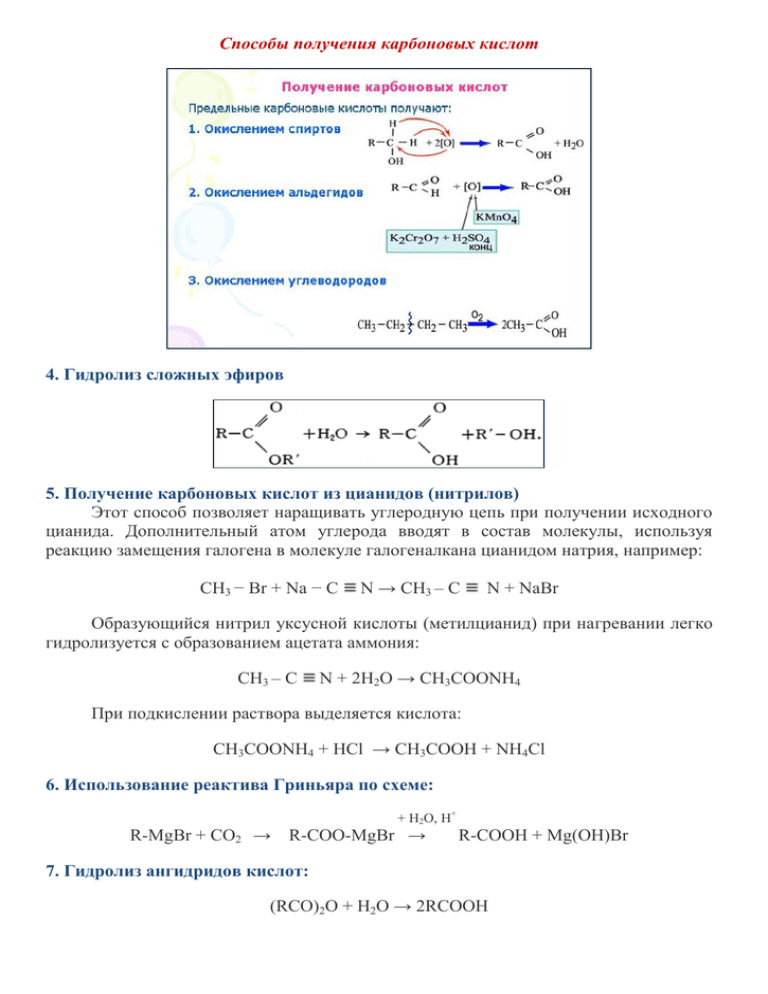
Общие способы получения карбоновых кислот 1. Окисление первичных спиртов и альдегидов под действием различных окислителей
55. Неорганическая химия. Тема 6. Неорганические соединения. Часть 14. Способы получения кислот
Способы получения кислот: Примеры реакций: Примечание: Взаимодействие простых веществ (неметаллов) с водородом (растворение газа в воде) Cl 2 + Н 2 → 2НСl↑. H 2 + S → H 2 S↑. HCl (газ) → +H 2 O → HCl.

Классы неорганических веществ презентация онлайн
Способы получения кислот Прежде чем выбрать способ получения кислоты, нужно выяснить, безоксигеновой или оксигенсодержащей она является, а также — сильной или слабой, летучей или.
Способы получения карбоновых кислот 4. Гидролиз сложных
Способы получения кислот через химические реакции; Примеры органических кислот и их использование; Технические кислоты: таблица свойств и области применения

Способы получения кислот YouTube
Существует несколько способов получения органических кислот: Химический синтез. Один из наиболее распространенных способов получения органических кислот - это их химический синтез. При этом используются различные реакции, включающие окисление, гидролиз, ацилирование и другие процессы.

Расскажем о С чем реагирует кислота в химии таблица с примерами
Получение карбоновых кислот. Присоединение натрий алкилов к двуокиси углерода: СH 3 Na + CO 2 = CH 3 COONa. Присоединение алкилмагниевых солей (реактив Греньяра) к двуокиси углерода: C 2 H 5 MgCl + CO 2 = C 2 H 5.

Способы получения оксидов, оснований, кислот и солей. Урок №2 презентация онлайн
Получение карбоновых кислот. 1. Окисление спиртов, алкенов и алкинов. При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия.

Способы получения оксидов, оснований, кислот и солей. Урок №2 презентация онлайн
В химии существует большое количество методов получения кислот, таких как окисление органических соединений, растворение металлов в кислотах, электролиз, воздействие огня и т.д.

Получение карбоноых кислот Химия. Четвёртый год изучения.
Другой способ получения кислот - это окисление соединений, содержащих соответствующий элемент. Например, серную кислоту можно получить путем окисления серы (S) кислородом (O₂) при высокой температуре и присутствии.
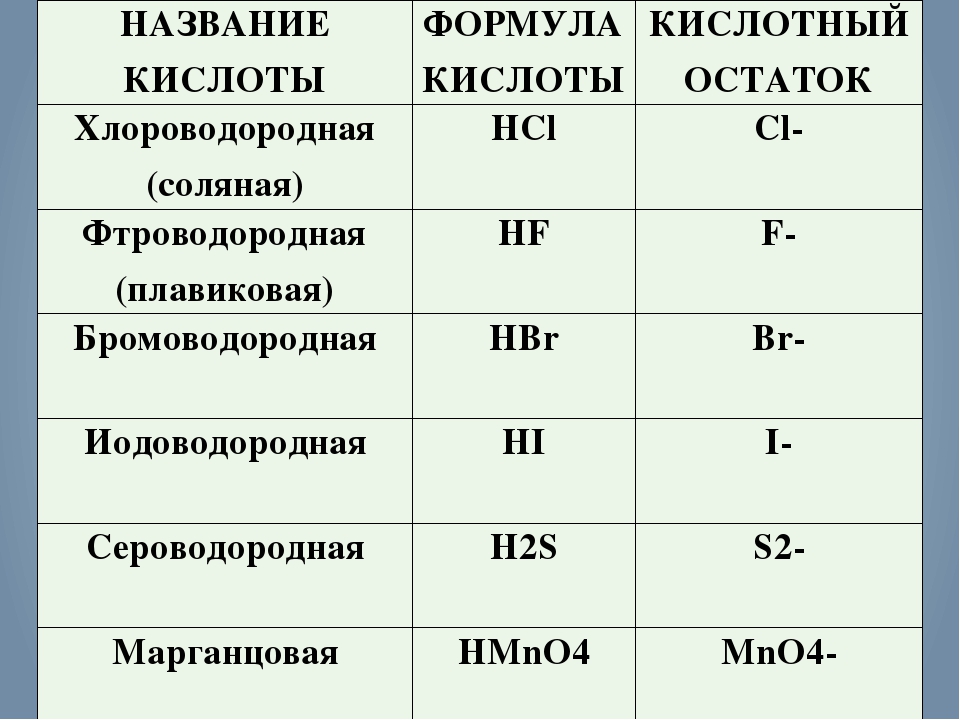
Бескислотные кислоты Общие способы получения кислот — урок. Химия, 89 класс.
Способы получения карбоновых кислот в реакциях: 5 эффективных методов Главная » Инструкции Карбоновые кислоты: способы получения и основные реакции На чтение 5 мин Опубликовано 10.10.2023 Обновлено 10.10.2023 Карбоновые кислоты — одни из самых важных органических соединений, которые используются во многих отраслях промышленности.

Способы получения оксидов, оснований, кислот и солей. Урок №2 презентация онлайн
Взаимодействие солей с кислотами (соль 1 + кислота 1 → соль 2 + кислота 2) NaCl (тв.) + H 2 SO 4 → HCl↑ + NaHSO 4. Наиболее часто используемый способ получения кислот в лаборатории

Кислоты. Состав кислот презентация онлайн
Получение карбоновых кислот путём окисления углеводородов. Самый простой способ окисления углеводородов — это их сжигание.

Химические свойства кислот и способы их получения online presentation
Cl2+H2O→HCl+HClO. Чтобы получить кислородсодержащую кислоту, можно: провести реакцию с участием кислотных оксидов (растворимых) и воды: P2O5+3H2O→2H3PO4, 2NO2+H2O→HNO3+HNO2 (в результате этой реакции образуется сразу две кислоты); использовать реакцию обмена между раствором соли и кислотой, являющейся более сильной.